Fixed Cell ATAC-Seq Kitの概要
新鮮な細胞や組織でATAC-Seqを行う場合は、ATAC-Seq Kitをお使いください。
Tn5 Transposaseのバルク注文はこちら
16サンプル以上のマルチプレックスをご希望の場合には、Nextera™-Compatible Multiplex Primers (96 plex)をご利用ください。
Diversi-Phi Indexed PhiX: Reliable diversity for every Illumina sequencing run
ATAC-Seqは、オープンな、すなわちアクセシブルなクロマチン領域を同定することにより、ゲノム全体のエピジェネティックな特徴の解析を可能にする迅速なアッセイです。アッセイの速さ、簡便さ、および幅広いサンプルタイプへの適用性から、ATAC-Seqは詳細なエピジェネティクス解析への入り口として一般的に使用されるアッセイとなってきています。
Fixed Cell ATAC-Seqアッセイでは、ホルムアルデヒドで固定した細胞から得た無傷な核を、高活性改変型Tn5 トランスポゼースと反応させます。このトランスポゼースは、タグメンテーション(tagmentation: tagging & fragmentationから生まれた造語)と呼ばれる過程において、標的DNAに対するシーケンス用アダプターの標識とDNA断片化を同時に行います。
アクティブ・モティフのFixed Cell ATAC-Seq Kitは、1反応当たり50,000~100,000個のホルムアルデヒドで固定した細胞から、16回のIllumina®互換ATAC-Seqライブラリー調製に必要な試薬を含んでいます。最適化されたプロトコールにより、サンプル調製、タグメンテーション、およびライブラリー調製が可能で、シングルフローセルシーケンスでマルチプレックス化できる次世代シーケンサー対応ライブラリーを作成することが可能です。
Fixed Cell ATAC-Seq Kitの特長
- ホルムアルデヒドで固定した細胞に最適化
- 50,000-100,000細胞で解析可能
- 簡便かつ迅速な最適化されたプロトコールと試薬
Fixed Cell ATAC-Seq Kitの構成品
Fixed Cell ATAC-Seq Kitは、ドライアイス納品(-20℃保管の構成品)1箱と室温納品(4℃および室温保管の構成品)1箱の合計2箱で出荷されます。製品受領後、マニュアル記載の条件に従って保管してください。すべての試薬は適切に保管した場合、受け取り日から6か月間安定であることを保証します。
Reagents included:
- Hypotonic Buffer, store at RT
- Hypotonic Quench, store at 4°C
- Releasing Buffer, store at RT
- Proteinase K, store at -20°C
- RNase A, store at -20°C
- Protease Inhibitor Cockatil, store at -20°C
- Assembled Transposomes, store at -20°C
- 2X Tagmentation Buffer, store at -20°C
- 10X PBS, store at RT
- 10% Tween 20, store at RT
- 1% Digitonin, store at -20°C
- 0.5 M EDTA, store at RT
- DNA Purification Columns SF, store at RT
- DNA Purification Binding Buffer, store at RT
- DNA Purification Wash Buffer, store at RT
- DNA Purification Elution Buffer, store at RT
- 3 M Sodium Acetate, store at RT
- 10 mM dNTPs, store at -20°C
- 5X Q5 Buffer, store at -20°C
- Q5 High-Fidelity DNA Polymerase, store at -20°C
- i7 Indexed Primer 1, store at -20°C
- i7 Indexed Primer 2, store at -20°C
- i7 Indexed Primer 3, store at -20°C
- i7 Indexed Primer 4, store at -20°C
- i5 Indexed Primer 1, store at -20°C
- i5 Indexed Primer 2, store at -20°C
- i5 Indexed Primer 3, store at -20°C
- i5 Indexed Primer 4, store at -20°C
- SPRI Beads, store at 4°C
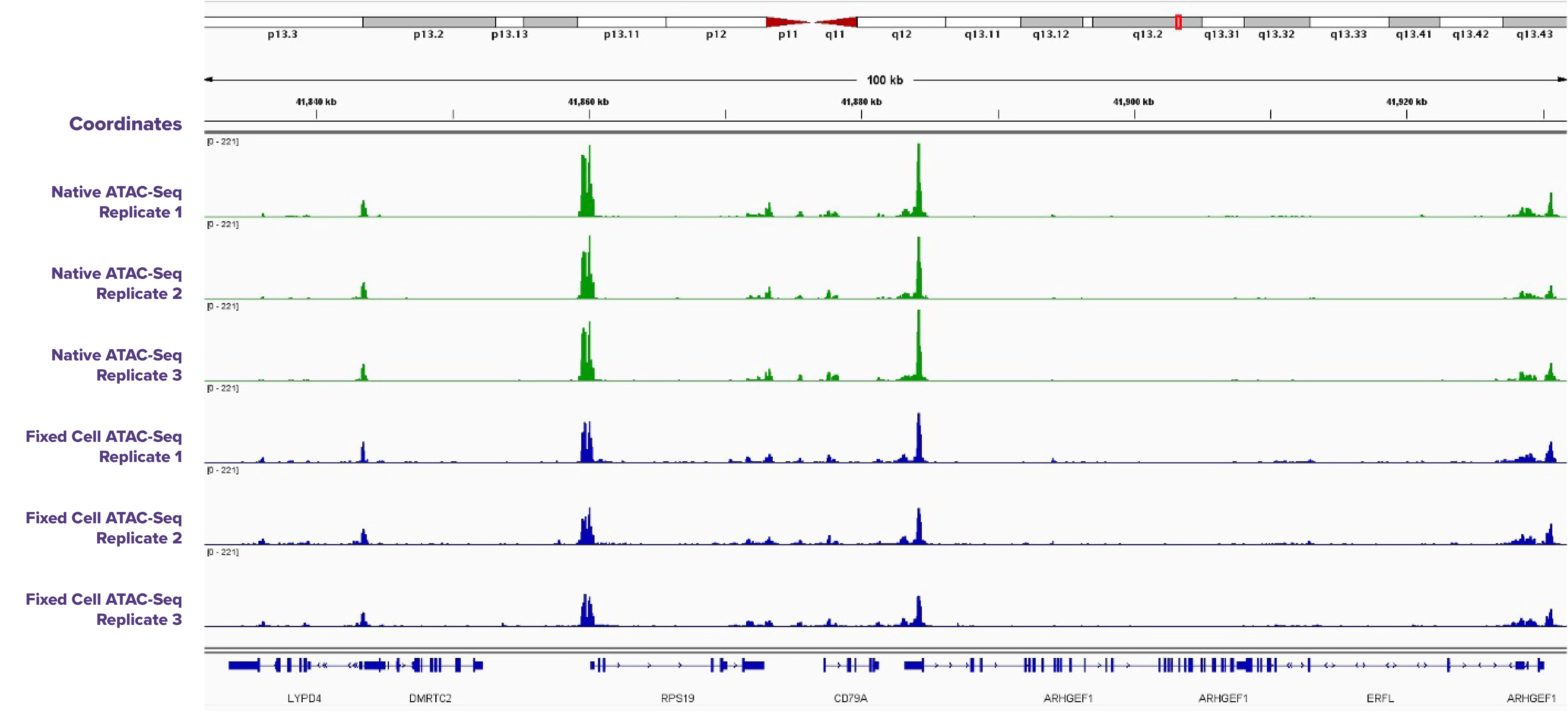
固定した細胞と未固定細胞を使ったATAC-Seqの結果の比較
Fixed Cell ATAC-Seq kitは、16回のATAC-Seq反応を実施するのに必要な試薬と酵素を含みます。キットの各構成品は最適化されており、高品質なATAC-Seqのデータが得られることが検証されています。
固定した細胞と未固定細胞を使ったATAC-Seqの結果の比較
図1: 固定した細胞と未固定凍結細胞を使ったATAC-Seqの比較
ピークプロファイルは、固定細胞と未固定細胞の間で類似している。一般的に固定細胞のATAC-Seqでは、バックグラウンドが高く、ピーク強度は低くなる。
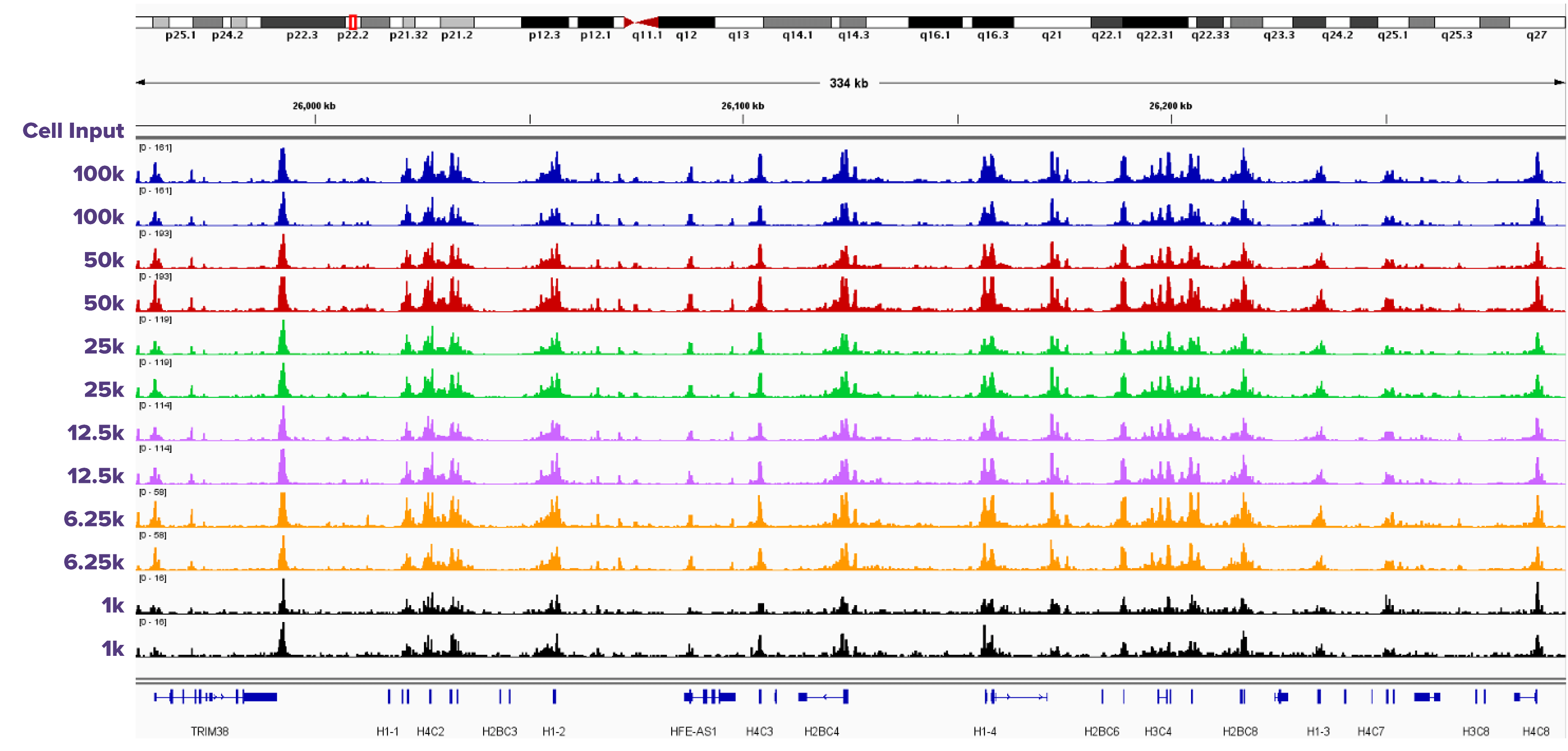
Fixed Cell ATAC-Seq は、1,000 から100,000個の固定した細胞に適応
図2: 固定した細胞の細胞数を変えたATAC-Seqの結果
ホルムアルデヒド固定したK562細胞を、それぞれ1,000、6,250、12,500、25,000、50,000、100,000個用いてFixed Cell ATAC-Seq kitでアッセイした結果 (n=2)。細胞数が少ないほどバックグラウンドは高くなるが、ピークプロファイルは一貫している。
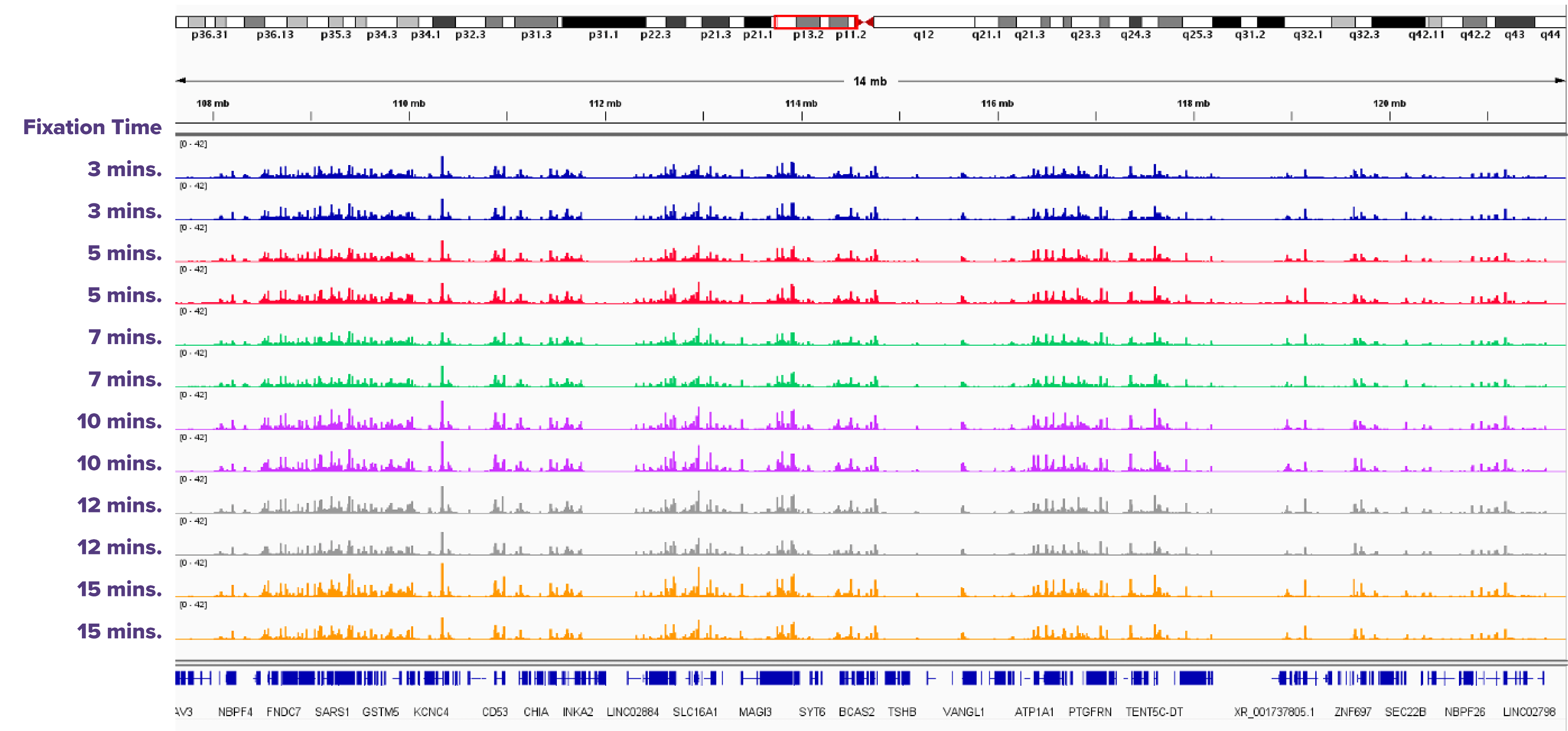
ホルムアルデヒドの固定時間を3-15分で検討した結果
図3: 50,000個のK562細胞の固定時間を変えたATAC-Seqの結果
50,000個のK562細胞を3、5、7、10、12、15分間ホルムアルデヒドで固定したサンプルの重複アッセイ。10分未満で固定された細胞では、より高いバックグラウンドが観察される。
ホルムアルデヒドで固定してからソートした血液細胞の例
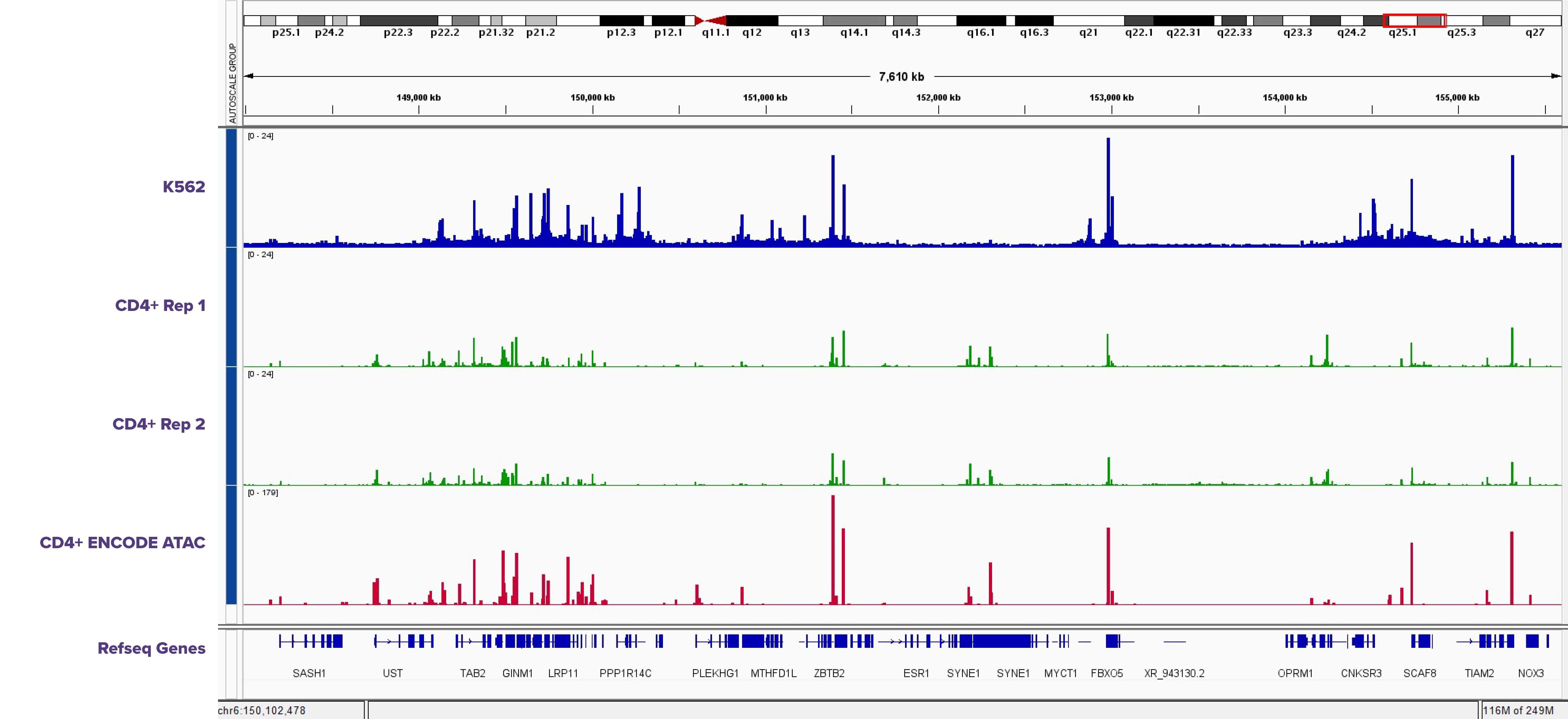
図4: K562細胞およびENCODE CD4+ データと比較した、ヒト血液サンプルから選別されたCD4+細胞のゲノムブラウザトラック
Fixed Cell ATAC-Seqは、200,000個のホルムアルデヒド固定選別CD4+ヒト血液細胞および200,000個のホルムアルデヒド固定K562細胞で実行した。ホルムアルデヒド固定CD4+とENCODE CD4+データの間で同様のピークプロファイルが観察され、ホルムアルデヒド固定CD4+とホルムアルデヒド固定K562細胞の間でいくつかのピークの違いが観察された。
ソートしてからホルムアルデヒド固定したB細胞の例
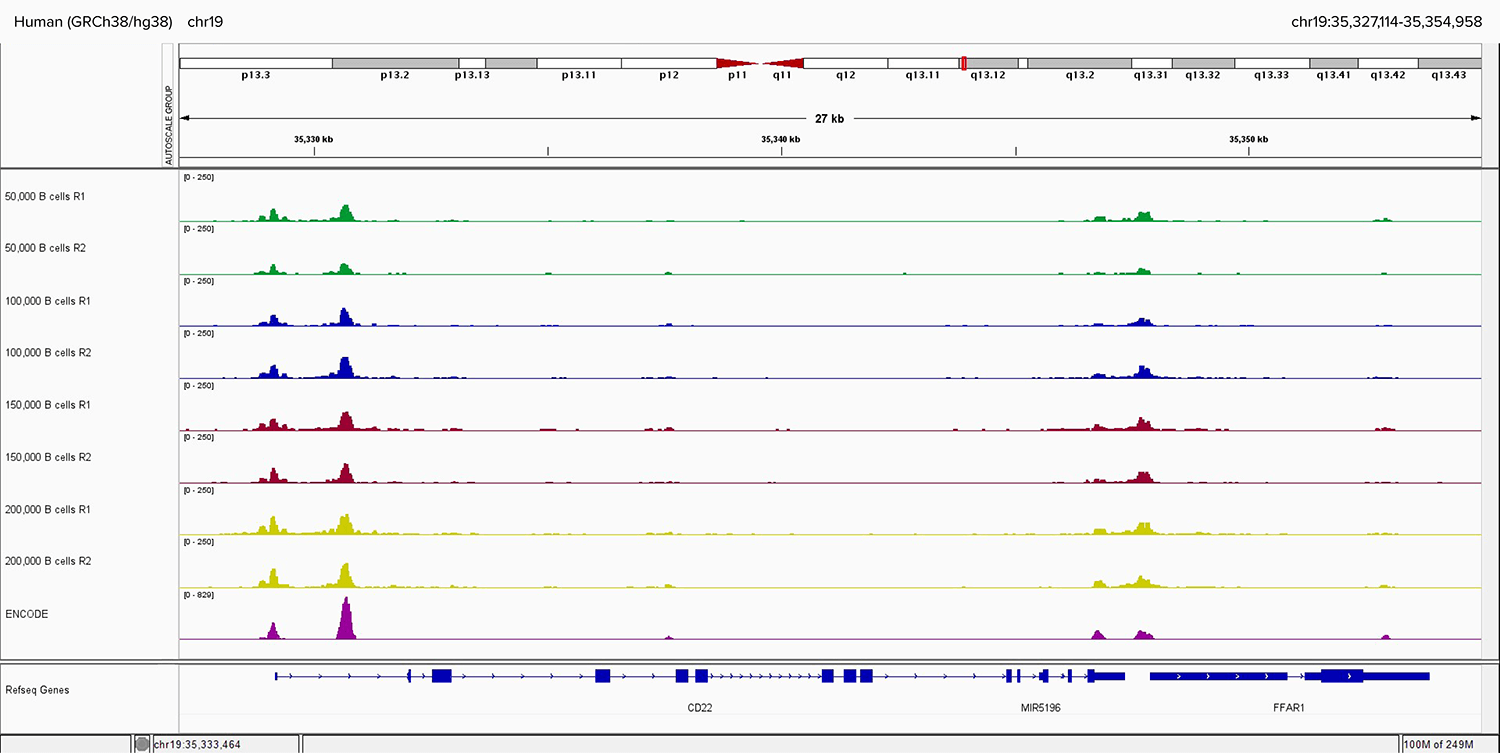
Figure 5. Genome Browser Results of Sorted and Formaldehyde-fixed Human B Cell Titration in Fixed Cell ATAC-Seq.
Sorted and formaldehyde-fixed B cells were run in duplicates of 50,000, 100,000, 150,000, and 200,000 cells. Genome browser data shown at the CD22 locus alongside ENCODE native human B cell ATAC-seq data.
Fixed Cell ATAC-Seq FAQs
推奨の細胞固定方法は?
マニュアルの推奨固定方法を参照してください。良い結果を得るためには、新鮮なメタノールフリーのホルムアルデヒドを利用してください。Thermo Fisher Scientific社から販売されているアンプルに分注されたPierce™メタノールフリー16% (w/v)ホルムアルデヒド(カタログ番号28906)を推奨しています。ホルムアルデヒド溶液を自作する場合には、サンプルを固定する直前に調製してください。
固定した細胞を超音波処理すると結果が改善される可能性はありますか?
いいえ、我々が行った検証では、固定した細胞を超音波処理しても、結果が改善されることはありませんでした。
なぜシーケンスの結果でバックグラウンドが高いのですか?
固定した細胞でATAC-Seqを行った場合、バックグラウンドが高くなる傾向があります。固定した細胞を使う場合、未固定細胞に比べてバックグラウンドが高くなってしまいます。文献4 (Zhang et al., 2022) を参照してください。
なぜライブラリーができないのですか?
最も考えられる原因はサンプルのロスです。Hypotonic Bufferを除く段階 (step11) と、タグメンテーション反応からReleasing Bufferへの変更のステップ (step19) における高速遠心後に、最低10 µLを残しておくことが重要です。
実験が失敗するのはなぜですか?
10-30 回のピペッティングと10分ごとのボルテックス撹拌は、step22のTagmentated DNA Releasing で重要です。この操作をしないと実験が失敗することがあります。
マスターミックスや酵素を含むすべての試薬やキット構成品を、室温で解凍・調製することは可能ですか?
Assembled TransposomeesとQ5 DNA Polymerase以外の試薬は、室温で解凍可能です。Assembled TransposomesとQ5 DNA Polymeraseはグリセロールが含まれており解凍の必要はありませんので、氷上に置いてください。その他の構成品は、凍結融解して反応に使用することができますので、16反応すべてを同時に行う必要はありません。
予想されるライブラリーのサイズとフラグメントアナライザーで解析した場合のサイズ分布(トレース)は、どのようなものですか?
ライブラリー断片の長さは約250 bpから1000 bpで、約150 bpの周期があることが望ましいとされています。トレースの実際の例は、ATAC-Seqキットのウェブページをご覧ください。
1サンプルあたり何リードのシーケンスが必要ですか?
通常、ペアエンドリードは3,000万で十分ですが、最低でも2,000万は必要です。リード数は、サンプルのゲノムサイズとATAC-Seqアッセイの解析目標に依存します。サンプルゲノムが非常に大きい場合、またはより高度な解析が必要な場合は、より多くのシーケンスリードが必要になる場合があります。
ATAC-Seqキットを使って、16サンプル以上のマルチプレックスを行うことはできますか?
Fixed Cell ATAC-Seq Kitには、16の個別のサンプルを識別するために、4x4のユニークなDual Indexが付属しています。キット内のインデックス付きプライマーは、N701-N704およびN501-N504に対応するillumina Nextera primerと同一です。16サンプル以上をマルチプレックスしたい場合は、Nextera™対応マルチプレックスプライマー (96 plex) キット (Cat.No. 53155) により、最大96反応までマルチプレックスすることができます。これらのプライマーは、アクティブ・モティフのキットで直接使用できるように25 µMの濃度に調製されています。また、キットに含まれるプライマーと同じ濃度 (25 µM) の他のillumina Nextera primersを購入して組み合わせることも可能です。
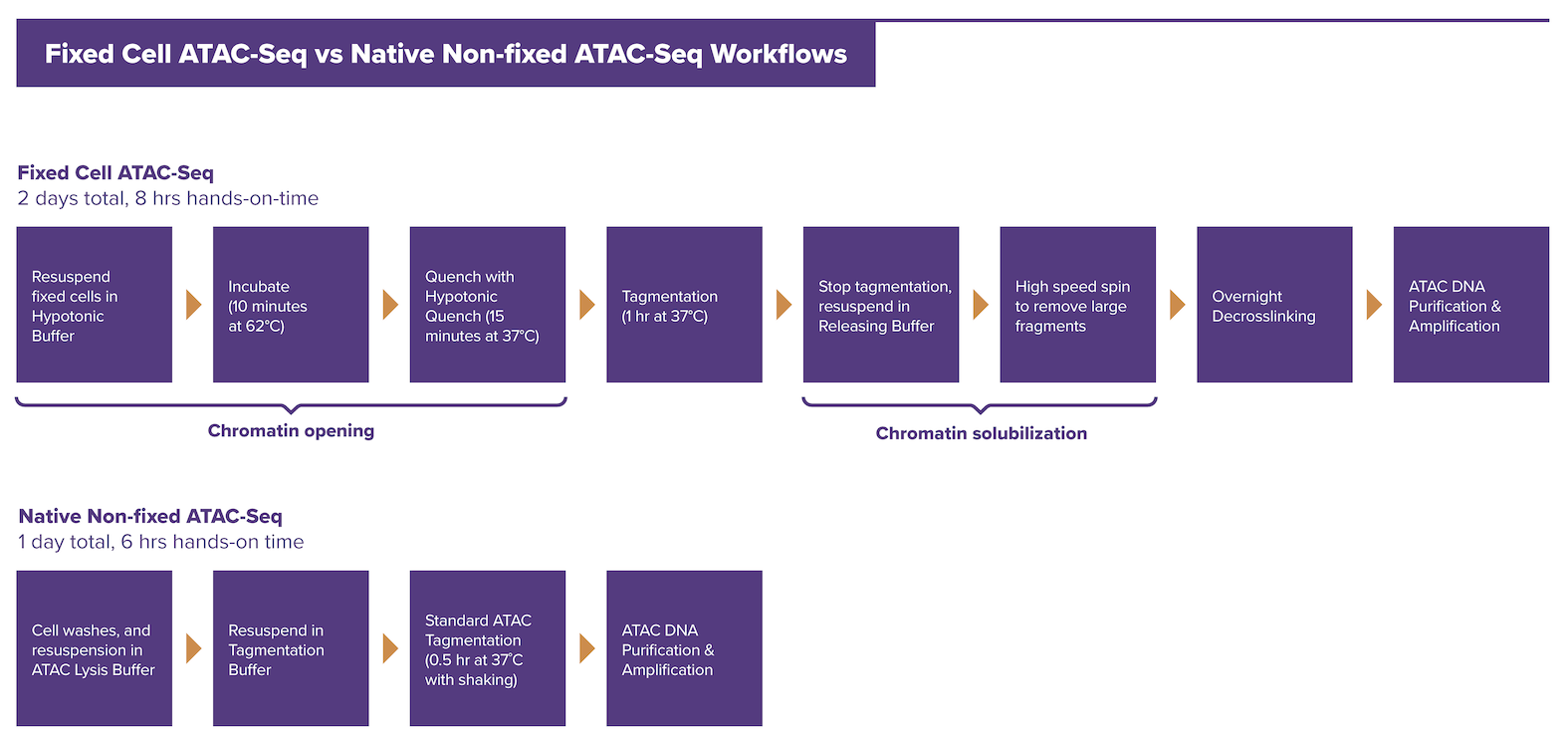
従来のATAC-Seq KitとFixed Cell ATAC-Seq Kitでは、どのようなプロトコルに違いがありますか?
Fixed Cell ATAC-Seq Kitの資料
こちらもご参照ください。
| Name | Format | Cat No. | 価格 (税抜) | |
|---|---|---|---|---|
| Fixed Cell ATAC-Seq Kit | 16 rxns | 53151 | ¥268,000 | Buy |