HDACとは?
ヒストン脱アセチル化酵素(HDAC: Histone deacetylase)は、タンパク質のリジン残基のアセチル基を除去する酵素の一種です。このアセチル基は、ヒストンアセチル化酵素(HAT: Histone acetylase)と呼ばれる別の酵素によって付加されます。HDACとHATが連携することで、細胞内のタンパク質のアセチル化状態が維持され、タンパク質の安定性やタンパク質間相互作用、遺伝子制御などに貢献しています。HDACの分類と機能に関するより詳しい情報は、こちらのレビューをご覧ください。
ヒストンアセチル化とクロマチン構造
HDACはヒストンタンパク質からアセチル基を除去するためだけに機能しているわけではありません。現在では、HDACが非ヒストンタンパク質からも同様にアセチル基を除去することは、よく知られています。ヒストンタンパク質に関しては、HDACはクロマチン構造の凝集と転写抑制に関与しているとされています。ヒストンテールにあるリジン残基をアセチル化すると、クロマチン構造が弛緩され、転写が活性化されます。HDACはこのアセチル基を除去し、クロマチン構造を「閉じた」状態に変化させます。
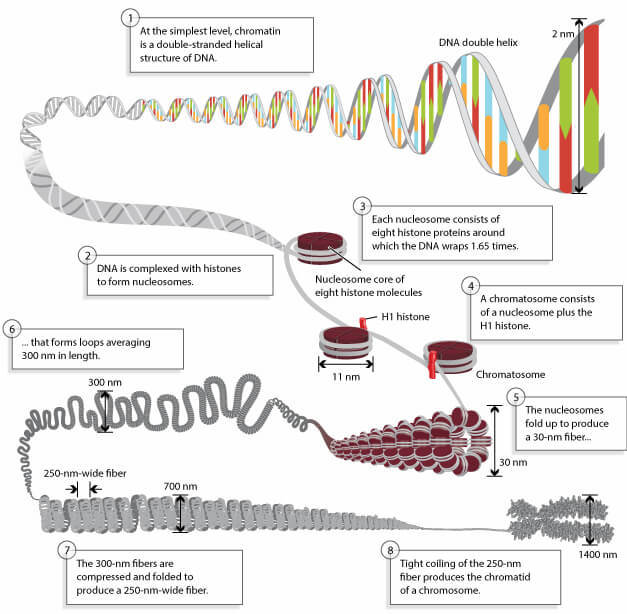
クロマチンは、ヒストンタンパク質とそれに巻きついたDNAで構成されています。ヒストンのアセチル化は、DNAがどれだけ「リラックス」してアクセスできるかということに影響します。
Pierce, Benjaminより引用。Genetics: A Conceptual Approach, 2nd ed. 無断転載禁止。
がんにおけるHDAC
HDACの異常な発現は、多くの論文で発表され、様々ながんで確認されています。一般に、HDACの発現量増加は、がん組織のバイオマーカー、予後不良の指標、生存率低下の予測因子として利用されることがあります。しかし、HDACの発現量増加が予後の改善につながるという報告や、一部のHDACが腫瘍抑制因子として働くというエビデンスもあります。HDAC阻害剤(HDACi)は、様々ながんや非がん性疾患 (関節リウマチなど) の治療に成功していますが、がんにおけるHDACの機能の矛盾から、HDACiの慢性投与がいつか治療による腫瘍形成を引き起こすことがあっても不思議ではないかもしれません。
HDAC解析のためのツール
HDAC活性測定
HDACを解析するための簡単な第一歩は、細胞から抽出した細胞内または核内の HDAC活性を調べることです。これにより、酵素活性の全体的な変化を確認することができます。
ELISAアッセイ
脱アセチル化されるタンパク質や基質を調べたい場合には、検証済みHDAC抗体とHDACタンパク質を用いたELISAアッセイやウェスタンブロットを用いることにより、特定のタンパク質上の特定の部位におけるアセチル化状態を、迅速かつ全体的に把握することができます。
Mod Specサービス
スクリーニング中の新しいHDACiに対して、どのタンパク質が脱アセチル化されているかをよりハイスループットに解析したい場合には、Mod Spec®サービスをご検討ください。
ChIP-seq
さらに一歩進んで、ChIP検証済み抗体を用いたChIP-seq行うことで、特異的にアセチル化されたタンパク質が結合しているゲノム上の位置を特定することが可能です。
RIME解析
特異的なアセチル化部位とゲノム結合部位を特定した後は、 RIME解析 によって、部位特異的に作用していると考えられるHDAC相互作用タンパク質を同定することができます。
どのようなツールを使っても、HDAC解析はクロマチン構造、タンパク質間相互作用、遺伝子発現制御に関する新しい仮説の世界を開き、疾患モデルのメカニズムを解明することができることでしょう。

